トピックス
21/11/16
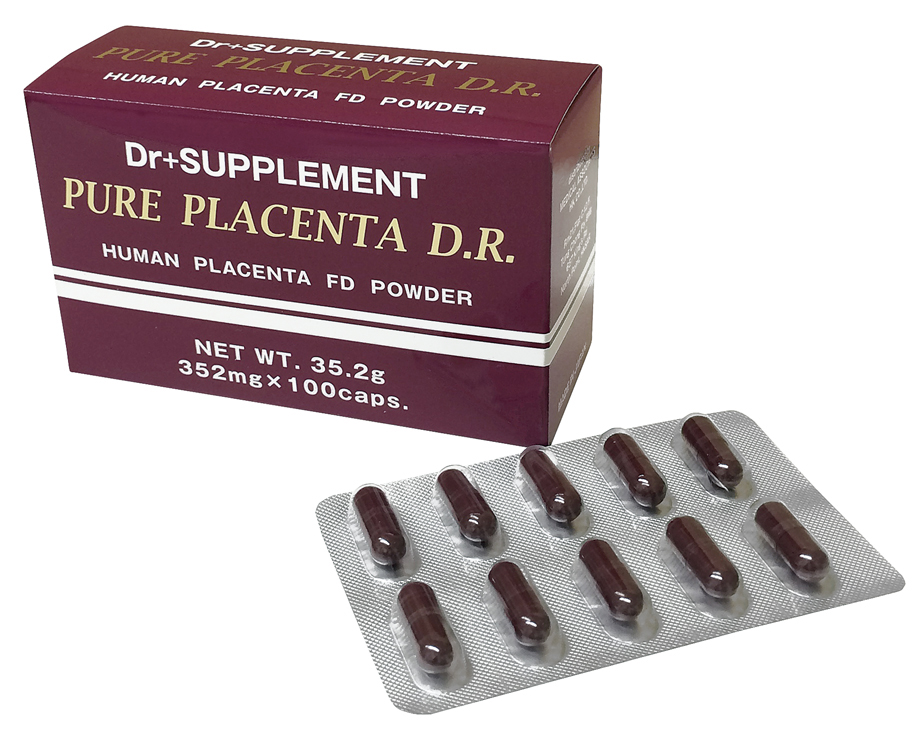
プラセンタ・・・Power Up新製品(ピュアプラセンタ D.R.)
サプリメント表示されていますが、医薬品で未承認薬です。
購入には、同意書が必要です。通販は行っていません。
本薬剤は日本製ですが、材料の入手経路と分析等の素性については、下記の文書を参考にされてください。
Power Upした新製品「ピュアプラセンタ D.R.」
プラセンタとは胎盤を意味します。胎盤を言い換えればヒトを育てる装置と言えるでしょう。
このヒト胎盤エキスは厚生省(現在、厚生労働省)が正式な薬剤として認可し、臨床応用されてから40年以上経過しています。本剤の有効性と安全性を裏付けています。
最近、プラセンタ製剤にヒト由来のものとウマブタ由来のものとがあります。
-
-
当院では、ヒトに用いるので、種の同じヒト由来のプラセンタ製剤のみを扱っています。
ヒューマンプラセンタ(ピュアプラセンタD.R.)は、国内の安全な胎盤 を凍結乾燥させた粉末で、各種サイトカイン(細胞増殖因子)を豊富に 含んだカプセルです。
この内服薬カプセルを2カプセル内服すると注射薬10アンプル分に相当します。
毎朝2カプセルを内服すると、毎日注射を10アンプル×30日で300アンプルの注射を投与されたことになります。
〈原料基準〉
- 日本の特別な契約をした16の病院(関東)において、胎盤提供者の1人1人について、ウイルス検査を実施し、ウイルス感染の無い健常妊婦の満期胎盤のみ原料としている。
- 未熟児、堕胎による胎盤は、一切使用いたしません。また、正常な胎盤のみ、病院内で即時冷凍保存されます。
- 日本国内以外でのヒト胎盤・臍帯の収集は一切行いません。
〈製造工程〉
日本国内でヒト由来プラセンタ原料の確固たる信頼と実績があり、医薬品GMPに準じる製造設備を持つ、国内最大原料メーカーによっ て、製造されています。この原料メーカーの製造するヒト由来プラセンタ原料は、厚生労働省より医薬品(OTC)の原料として承認されていますので、その品質と安全性は証明されています。
- 原料メーカーに納品時、ウイルス検査を実施し、安全が確認された原体のみ、胎盤と臍帯を分離して、乾燥末の製造工程に入ります。
- 製造工程の中で加熱滅菌処理が行われ、減圧凍結乾燥された乾燥胎盤を粉砕・ろ過(80メッシュ、約0.18mm)し、乾燥末原料が得られます。
- 乾燥末原料について、一般細菌・重金属試験、再度ウイルス試験などの安全試験を実施。規格内の乾燥末原料のみ製品に配合されます。
-
 ウイルス試験成績書
ウイルス試験成績書 -
 原料ロット毎、実施
原料ロット毎、実施
原料規格①
本品配合の原料(350mg/1cap)は、ヒト胎盤を乾燥粉砕して得た100% プラセンタ乾燥末です。
| 項目 | 内容 |
|---|---|
| 性状 | 本品は、淡褐色~褐色の粉末で、固有な香味を持つ |
| 乾燥減量 | 8.0% 以下(1g, 105℃, 1 時間) |
| 強熱残分 | 10% 以下 (2g) |
| 総窒素 | 10.6 ~ 16.0% ( セミミクロケルダール法) |
| ヒ素 | 2ppm 以下 (1.0g, 第 3 法 装置 B) |
| 重金属 | 20ppm 以下 (1.0g, 第 2 法 比較液、鉛標準液 2.0ml) |
| 一般細菌数 | 1000/g 以下 (SCDLP 培地) |
| 大腸菌数 | 陰性 |
原料規格②
ウイルス検査は下記すべての試験において、陰性である。
- (1) HIV 抗原・抗体
- 指定の希釈倍率で調整した本品につき測定するとき、COI は 1.00 未満である。(CLEIA 法)
- (2) TPHA ( 定量 )
- 指定の希釈倍率で調整した本品につき測定するとき、陰性である。(PA 法)
- (3) HCV-RNA ( 定量 )
- 指定の希釈倍率で調整した本品につき測定するとき、1.2LogIU/ml 未満であり、増幅反応シグナルは、検出されない。(リアルタイム PCR 法 )
- (4) HBs 抗原 ( 定量 )
- 指定の希釈倍率で調整した本品につき測定するとき、陰性である。(CLIA 法 )
アミノ酸量分析
(内容量100g中)単位g
| 成分 | ピュアプラセンタD .R . | A社製品 |
|---|---|---|
| アルギニン | 4.98 | 4.43 |
| リジン | 4.92 | 5.56 |
| ヒスチジン | 2.02 | 1.65 |
| フェニルアラニン | 2.96 | 3.35 |
| チロシン | 1.96 | 2.46 |
| ロイシン | 5.36 | 6.47 |
| イソロイシン | 1.92 | 2.11 |
| メチオニン | 1.06 | 1.25 |
| バリン | 3.81 | 4.34 |
| アラニン | 5.54 | 4.82 |
| グリシン | 9.66 | 5.62 |
| プロリン | 6.31 | 4.33 |
| グルタミン酸 | 8.81 | 8.64 |
| セリン | 3.46 | 3.58 |
| スレオニン | 2.98 | 3.52 |
| アスパラギン酸 | 6.43 | 6.89 |
| トリプトファン | 0.69 | 0.82 |
| シスチン | 0.86 | 0.95 |
| 合計 | 73.73 | 70.79 |
サイトカイン量分析
ピュアプラセンタ D.R.(1cap) /A社製品 (1cap) / A社 注射薬 (1A 2ml) / 単位pg
| 項目 | ピュアプラセンタD .R . | A社製品 | A社注射薬 |
|---|---|---|---|
| EGF | 112.4 | 2.5 | 5.2 |
| FGF | 816.9 | 166.3 | 8.6 |
| HGF | 1305.2 | 148.4 | 260 |
(原料メーカー測定)


